新闻动态

新捷报,捷闻报 了解最新捷闻咨询
捷闻说丨重点产品注册分享:牙科膜片的FDA 510(k)怎么做?

2023-09-28
原文网址:https://mp.weixin.qq.com/s/mKzCOfW4tdq3L8O0pcY7MA

近期,捷闻成功协助客户完成了牙科膜片的 FDA 510 (k) 注册。
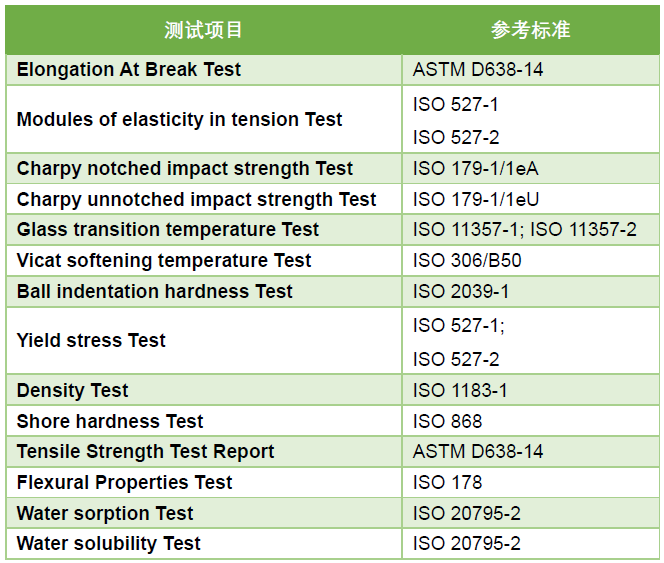
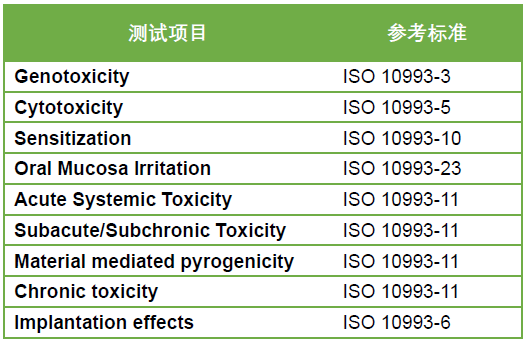
本期介绍的牙科膜片,具有一定的弹性、抗压、易塑性,物理性能稳定。结构为圆形或方形的单层片状结构。该产品可用于制作运动护齿合垫、托槽定位转移合垫、正位合垫等。


本期,捷闻将在牙科膜片的FDA 510 (k)注册方面为大家提供一些Tips
美国医疗器械风险分类一般分为三类:Class I, Class II 和Class III,风险等级由低到高。根据不同的产品风险等级,采用不一样的管制方式,Class I的管制是一般管制, class II的管制方式是一般管制+特殊管制, 而class III则是一般管制+上市前批准。根据不同的管制方式会有不同的申请方式(submission type)。
FDA这个组织全称为FOOD AND DRUG ADMINSTRATION(食品药品监督管理局),该组织的作用是:监管:食品、药物、医疗器材、生物制品、饲料和动物用药品、化妆品和电子辐射产品必须经过FDA检验证明安全后,方可在美国市场上销售。
FDA有权对生产厂家进行视察、有权对违法者提出起诉。
而FDA的组织下存在很多部门,我们医疗器械常常会接触到的部门是Center for Device & Radiological Health (CDRH) 和Center for Biologics Evaluation & Research (CBER)。牙科膜片的医疗器械申请是有CDRH部门监管的。
510 (k)的申请是需要企业向FDA递交的产品上市前的一系列申请文件,目的是证明所申请上市的产品和已在美国市场上合法销售的产品在安全性和有效性方面比较是实质等同的,即实质性等同器械(substantially equivalent)。在这个过程中我们需要将申请上市的器械与当前美国市场上一种或多种相似器械进行对比,以得出支持等价器械的结论,从而完成申请。
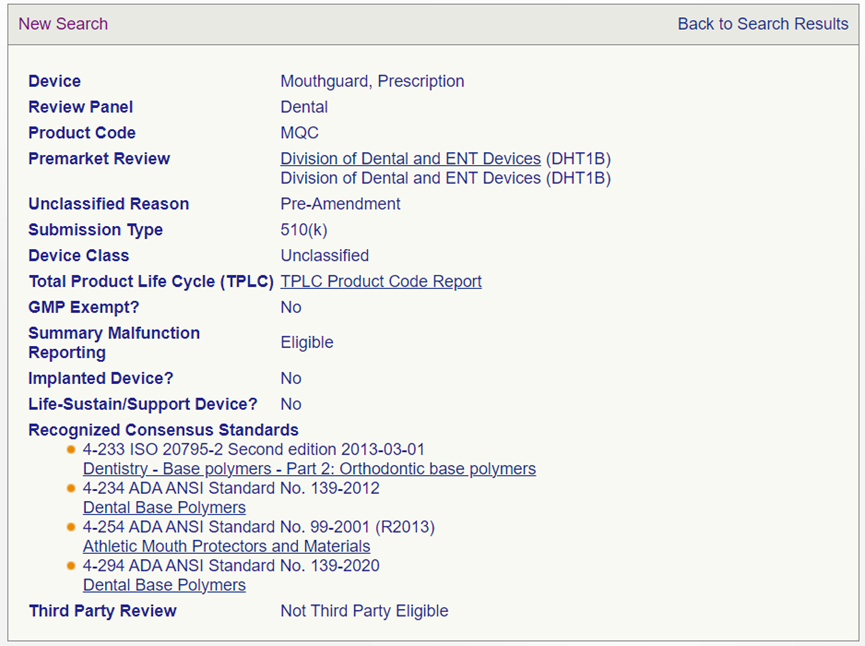
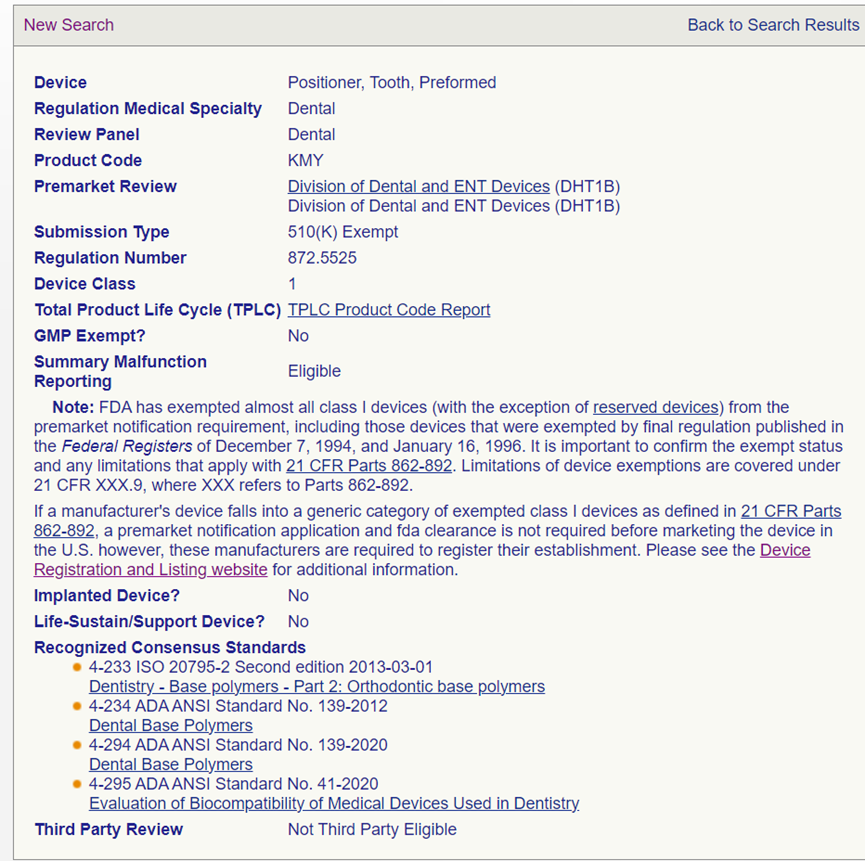
牙科膜片适用2个产品代码:MQC和KMY。其中MQC代码:产品分类为Unclassified,要求的递交类型为510(k);KMY代码: 产品分类为 Class I,递交类型为510(k) Exempt。根据上述2个产品代码的监管要求,应当考虑监管级别要求更高的申请类型。所以牙科膜片在FDA属于Unclassified的产品,且需要递交510 (k) 申请。
unclassified是指尚未颁布分类法规的修正前(pre-amendments)器械。在unclassified器械类型被正式分类并制定法规之前,销售该类型的新器械需要向 CDRH 或 CBER 提交510(k) 上市前通知。一旦分类,这些器械可能需要提交 PMA、510(k) 或免于提交任何上市前申报。not-classified是修正后的器械,但机构尚未对其上市申请进行审查,或尚未对其上市申请做出最终决定。
End
获取更多相关信息, 您也可以直接联系我们。
我们将竭诚为您服务!
![]()
联系我们