新闻动态

新捷报,捷闻报 了解最新捷闻咨询
端午•同舟共济 | MDSAP成功获证是什么体验?(内附MDSAP详解)

2021-06-11
原文网址:https://mp.weixin.qq.com/s/DkSyAe10SqA0S2na52K8og


01 什么是MDSAP?

MDSAP ( Medical Device Single AuditProgram) 医疗器械单一审核程序,是国际医疗器械监管者论坛IMDRF(International Medical Device Regulators Forum) 的 MDSAP 监管机
构委员会发起的。
MDSAP 也就是我们俗称的五国联审。五国联审,是美国(FDA)、澳大利亚(TGA)、巴西(ANVISA)、加拿大(HC)、日本(MHLW)五国的监管机构认可并加入的一套新的审
核程序。
通过MDSAP,制造商可以用相同的成本通过单一审核,满足五个国家质量体系监管要求,避免重复审核,不必经常被迫为各种各样的检查或审核作准备。
02 目前参与 MDSAP 监管机构:
|
|
|
|
|
官方观察员:
|
区域协调倡议:
●● APEC LSIF Regulatory Harmonization SteeringCommittee 亚太经合组织 LSIF 规管协调督导委员会
●● Asian Harmonization Party 亚洲协调方
03 MDSAP与ISO 13485 的关系

●● 澳大利亚:治疗物品法令、治疗品 (医疗器械) 条例
●● 巴西:AVISA 市场前批准、ANVISA良好的生产实践、ANVISA GMP 认证-产品注册要求、ANVISA PMS RC 和 RDC
●● 加拿大:食物和药物法令 R.S.C、SOR
●● 日本:厚生省部长条例1 69号
●● 美国:21 CFR 820、21CFR 803、21 CFR 806、21 CFR 821
04 MDSAP与ISO 13485 的区别
Criteria标准 | ISO 13485 | MDSAP |
Program Customer 程序客户 | Manufacturer 制造商 | Regulator 监管机构 |
Output of Success 结果输出 | Certificate 证书 | Report and Certificate 报告和证书 |
Auditing Organization Qualification 审核组织资质 | Competent Body 主管机构 | Regulatory Witness and Audit 监管机构见证和审核 |
Nonconformity Grading 不合格等级 | Major/Minor 重大/轻微 | 1, 2, 3, 4, 5 |

05 MDSAP与国主管当局的审核
●● 在加拿大,加拿大健康局(HC)已正式宣布用MDSAP证书取代原有的医疗器械符合性审核程序(CMDCAS)证书,并且决定从2019年1月1日实施。所有出口到加拿大的II类、III类和IV类
医疗器械都必须拥有MDSAP证书,才能去加拿大健康局(HC)注册销售产品。
●● 在日本,日本厚生劳动省(MHLW)和药品医疗器械管理局(PMDA)认可MDSAP审核报告,豁免现场审核,并允许上市持有人(MAH)用MDSAP的报告作为提交的注册的相关文件。
●● 在澳大利亚,主管当局(TGA)继续根据MDSAP的审核结果去颁发和维持TGA的符合审核的证书,并可能豁免TGA的常规审核。
●● 在美国,美国食品药品监管局(FDA)认可和使用MDSAP审核报告作为豁免FDA常规审核。但有因检查和高风险PMA的产品除外,另外FDA 检查所提出的检查发现(483),也不能用
MDSAP审核来关闭。
●● 在巴西,主管当局(ANVISA)对III类和IV类的产品需要执行上市前和上市后的GMP审核,可以将MDSAP的审核结果替代上市前的GMP审核和每两年一次的上市后的常规审核。
●● 世界卫生组织(WHO):可使用MDSAP的审核结果,作为符合国际质量管理体系法规的证据,从而可豁免或者缩减体外诊断产品的资格审查。
06 MDSAP的审核周期
MDSAP的审核周期和ISO 13485一样,也是3年一个循环,包括初次的正式审核、正式审核之后的第一年和第二年为监督审核、第三年为再认证审核。
初次的正式审核包括第一阶段和第二阶段,第二阶段会对医疗器械制造商的质量管理体系(QMS)进行完整的审核。
和ISO13485不同的是审核时间的计算,ISO 13485的审核以企业的员工人数计算人天,而MDSAP以审核的任务(Task)来计算人天。申请企业因为需要满足的法规、产品、体系的流程和任务
不同,人天会有差异,通常初次的正式审核需要6-7个人天。
1. 管理
2. 测量、 分析和改进
3. 设计和开发
4. 生产和服务管控
以及三个辅助过程:
1. 采购
2. 器械销售授权和设备登记
3. 医疗器械不良事件和忠告性通知报告
他们的具体任务可参考下表:
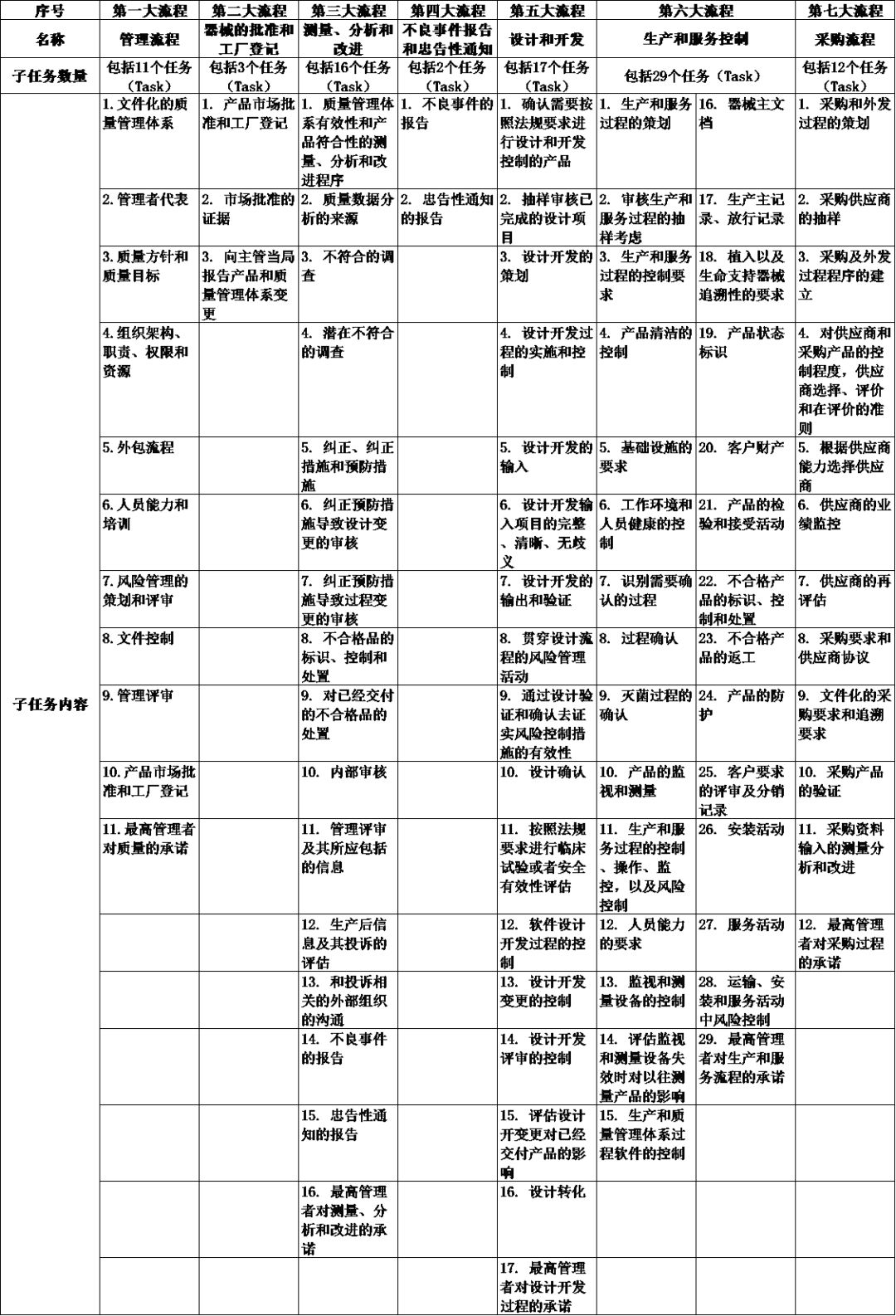
08 MDSAP审核发现的分类和不符合报告
MDSAP的审核完成之后要完成MDSAP的法规审核报告和不符合报告,该法规审核报告和不符合报告的模板由MDSAP的项目组开发。
MDSAP的审核发现按照GHTF的指南文件《医疗器械质量管理体系-用于法规目的和信息交流的不符合分级准则GHTF/SG3/N19:2012》分为5个等级。
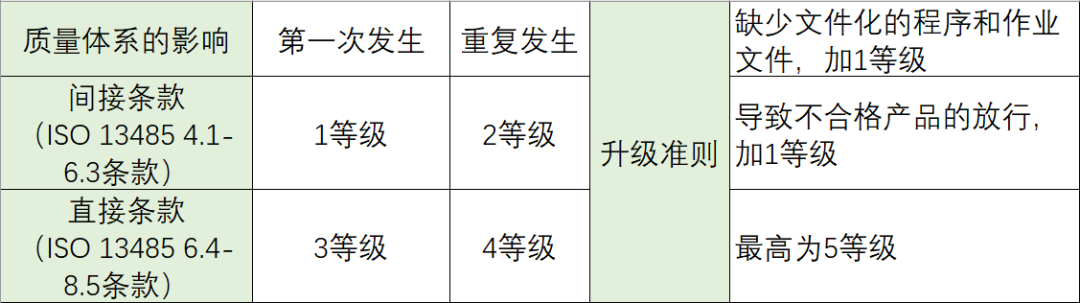


* 该客户为何选择Share Info辅导MDSAP?
本次MDSAP辅导老师简介:


获取更多相关信息, 您也可以直接联系我们。
我们将竭诚为您服务!

End




 澳大利亚治疗商品管理局(TGA)
澳大利亚治疗商品管理局(TGA) 巴西卫生监督局(ANVISA)
巴西卫生监督局(ANVISA) 加拿大卫生部(HC)
加拿大卫生部(HC)
 美国食品药品监督管理局(US FDA)
美国食品药品监督管理局(US FDA) WHO 世界卫生组织
WHO 世界卫生组织