新闻动态

新捷报,捷闻报 了解最新捷闻咨询
捷闻说 | 中、欧、美“新冠抗原试剂盒”临床要求差异对比——中国篇

2022-04-01
原文地址:https://mp.weixin.qq.com/s/L8BUcMI4tntDerBnt9Zezw

从2020年国家药品监督管理局(NMPA)就批准下来的3款新冠抗原试剂,到目前的21款(截止2022年3月31日);从各省市
陆续挂网集采抗原试剂,到国家医保局规定抗原检测最高限定费用。每天都有新的“抗原故事”。
要问现在准备新冠抗原NMPA注册还有机会吗?还是那句话:风险与机遇共存,早一天进入,就少一份风险。从目前形势来看,
新冠在未来几年与我们共存将会是是一个常态。新冠在,检测需求就在。
这周,我们继续NMPA“新冠抗原检测试剂注册技术审评要点”中的NMPA临床要求解读。

新冠抗原试剂盒NMPA临床要求
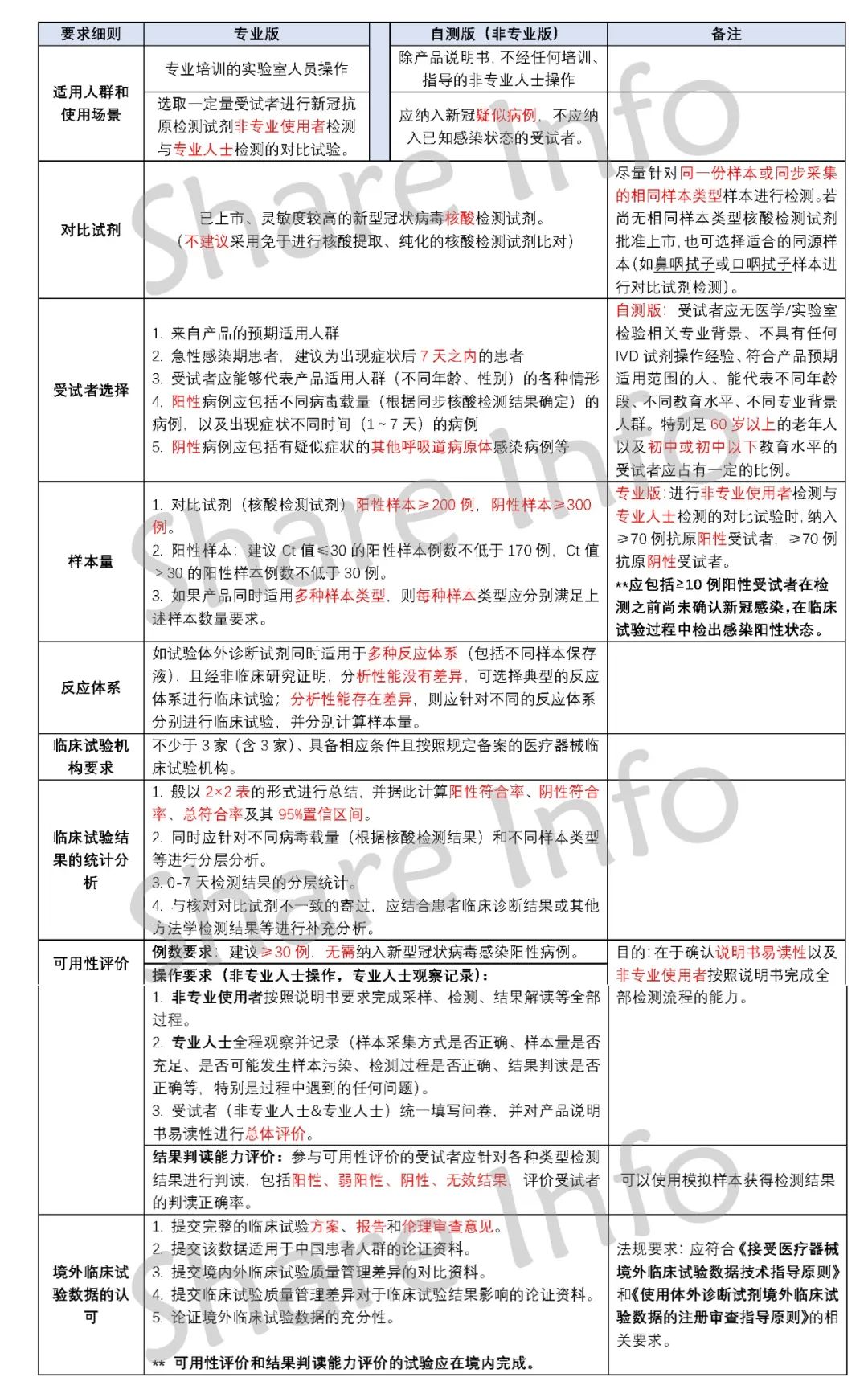
(可在捷闻微信公众号后台回复 “NMPA ”获取高清图片)
以上就是新冠抗原试剂盒NMPA临床要求。可以看到,要求中隐含了许多临床试验的难点安。若企业之前没有在任何其他海外上市(有海外临床基础),按照此要求进行全新的临床试验,可谓其路漫漫!
对于NMPA临床要求,若有任何其他疑问或需要交流的地方,欢迎随时后台联系我们。
下一期,我们进入中欧美新冠抗原试剂盒临床要求最终篇——美国临床要求!
End
![]()
联系我们








