新闻动态

新捷报,捷闻报 了解最新捷闻咨询
捷闻说 | 中、欧、美“新冠抗原试剂盒”临床要求差异对比——欧盟篇

2022-03-25
原文网址:https://mp.weixin.qq.com/s/OuLX6JDiULF94HuIEFCGiA

要问现在哪个IVD企业最牛?当然是同时拥有NMPA+CE+FDA准入的新冠抗原试剂盒厂家。
要问现在IVD企业启动临床,准备注册还有机会吗?当然是风险与机遇共存,早一天进入,就少一份风险。
对于有意愿布局新冠试剂盒全球市场的企业来说,首先要考虑的就是临床了。
不知道这两年有多少企业因为不了解海外临床要求和IVD法规,走了多少弯路,浪费了多少时间和金钱成本。
为了帮大家捋清中国NMPA、欧盟CE、美国FDA的临床要求,捷闻Share Info特此制作超强解读——中、欧、美“新冠抗原试剂盒”临床要求差异分析(分上、中、下篇进行)。
今天,我们进行上篇:欧盟MDCG 2021-21 Rev.1对新冠抗原试剂的临床要求

关于新冠检测产品的临床要求,欧盟其实在去年8月就出《MDCG 2021-21 Guidance on performance evaluation of SARS-CoV-2 invitro diagnostic medical devices》,在今年有做了第一版更新,目前最新执行版本是MDCG 2021-21 Rev.1。
看到指南别慌,最精华的其实是其中几个表格(table)的内容:
● 表1(Table 1):如果是新冠IgG抗体(仅IgG、结合IgM和/或IgA的IgG以及总抗体)检测产品,包含快检试剂盒,临床要求需要参考此表。
● 表2(Table2):如果是新冠IgM和/或IgA的检测产品,包括快速检测,临床要求需要参考此表。
● 表3(Table 3):规定了抗体类新冠检测产品的验证性或补充性检测要求。
● 表4(Table 4):如果是新冠抗原检测产品,包括快检试剂盒,,临床要求需要参考此表。
● 表5(Table 5):如果是新冠RNA核酸扩增技术(NAT)产品,临床要求需要参考此表。
● 表6(Table 6):是新冠抗原自测产品的附加要求。
● 表7(Table 7):是新冠抗体自测产品的附加要求。
由此可见,和目前市场上需求最大的“新冠抗原试剂盒”关系最大的就是表4,如果是自测产品,就再加上表6的相关要求。因此,读懂表4和表6,可以解决90%的问题。表4和表6的要求,请见如下汇总。
新冠抗原试剂盒欧盟临床要求
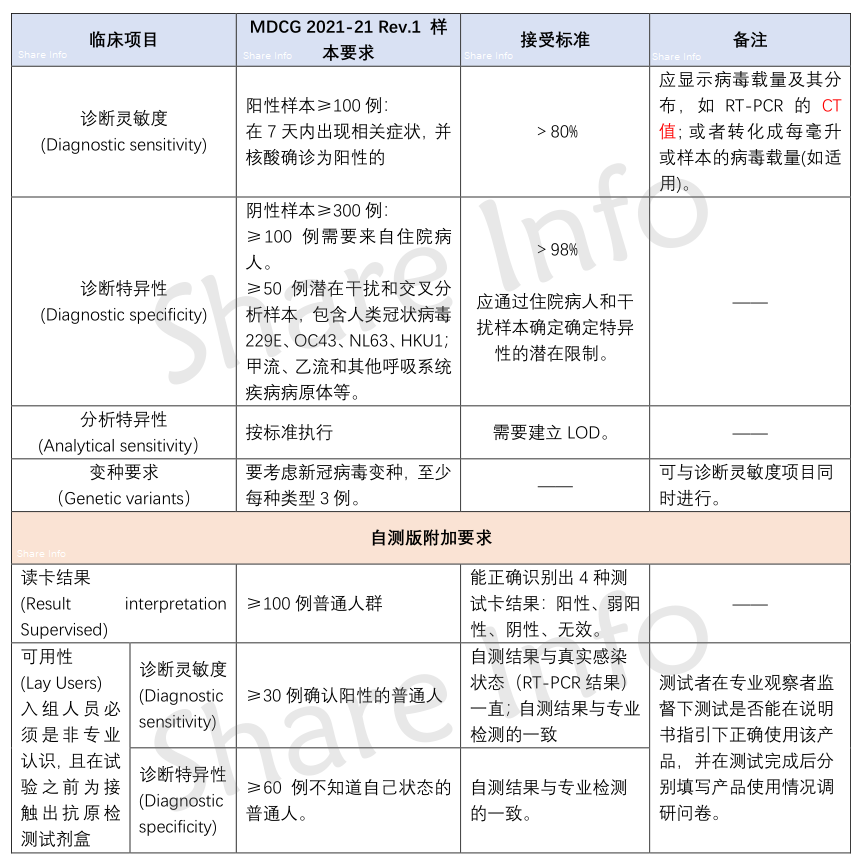
欧盟“新冠抗原试剂盒”临床要求今天就分析到这里,
请期待后续中篇及下篇:中、美临床要求~



